14 बच्चों की मौत: केंद्र ने राज्यों को चेताया — मिलावट वाली खाँसी की सिरप पर कड़ी निगरानी बढ़ाएं
- byAman Prajapat
- 06 October, 2025

जब हम कहते हैं कि “दवा से जीवन बचता है”, तो आज की घटना यह एहसास दिलाती है कि दवा अगर संदिग्ध हो, तो वह जीवन को भी छीन सकती है। मध्य प्रदेश के छिंदवाड़ा जिले से शुरू हुई एक त्रासदी — 14 से अधिक बच्चों की मौत — ने पूरे देश में हड़कंप मचा दिया है। मौत का कारण एक खाँसी की सिरप (cough syrup) पाई गई है, जिसमें जोखिम से अधिक मात्रा में डाइएथिलीन ग्लाइकोल (DEG) मिला हुआ था — एक जहरीला रसायन। केंद्र सरकार ने तुरंत एक उच्च स्तरीय बैठक बुलाई और राज्यों को सख्त निर्देश दिए हैं कि वे निगरानी बढ़ाएँ, रिपोर्टिंग मजबूत करें और मिलावट वाली दवाओं के खिलाफ कार्रवाई तेज करें।
यह घटना न केवल स्वास्थ्य प्रणाली की संवेदनशीलता पर सवाल खड़ा करती है, बल्कि दवा विनियमन, दवा निर्माण प्रक्रिया, गुणवत्ता नियंत्रण और सार्वजनिक विश्वास — इस सब की परीक्षा है।
घटना का संक्षिप्त वर्णन
समाचार स्रोतों के अनुसार, मंगलवार (5 अक्टूबर 2025) को यह खबर सामने आई कि कम से कम 14 बच्चों की मौत उन राज्यों (मध्य प्रदेश और राजस्थान) में हुई है, जिन्होंने खाँसी की एक सिरप का सेवन किया था, जिसमें असामान्य मात्रा में DEG पाया गया।
इस मुद्दे को गंभीरता से लेते हुए, केंद्रीय स्वास्थ्य विभाग ने राज्य स्वास्थ्य सचिवों, दवा नियंत्रक अधिकारियों और अन्य संबंधित विभागों को तत्काल एक बैठक में आमंत्रित किया।
बैठक में यह निर्देश जारी किया गया कि सभी स्वास्थ्य संस्थाएँ — सरकारी और निजी — Integrated Disease Surveillance Programme (IDSP) और Integrated Health Information Platform (IHIP) के माध्यम से समय पर रिपोर्टिंग करें।
दवा विनियमन प्राधिकरणों को बताया गया कि वे Revised Schedule M (GMP – Good Manufacturing Practices) का कड़ाई से पालन सुनिश्चत करें और जो निर्माण इकाइयाँ मानकों को नहीं पूरा कर रहीं हैं, उनके विरुद्ध सख्त कार्रवाई हो।
इसके अलावा, 19 दवा निर्माण इकाइयों में Risk-Based Inspections (RBI) की शुरुआत की गई है, ताकि दोषपूर्ण इकाइयों की पहचान हो सके।
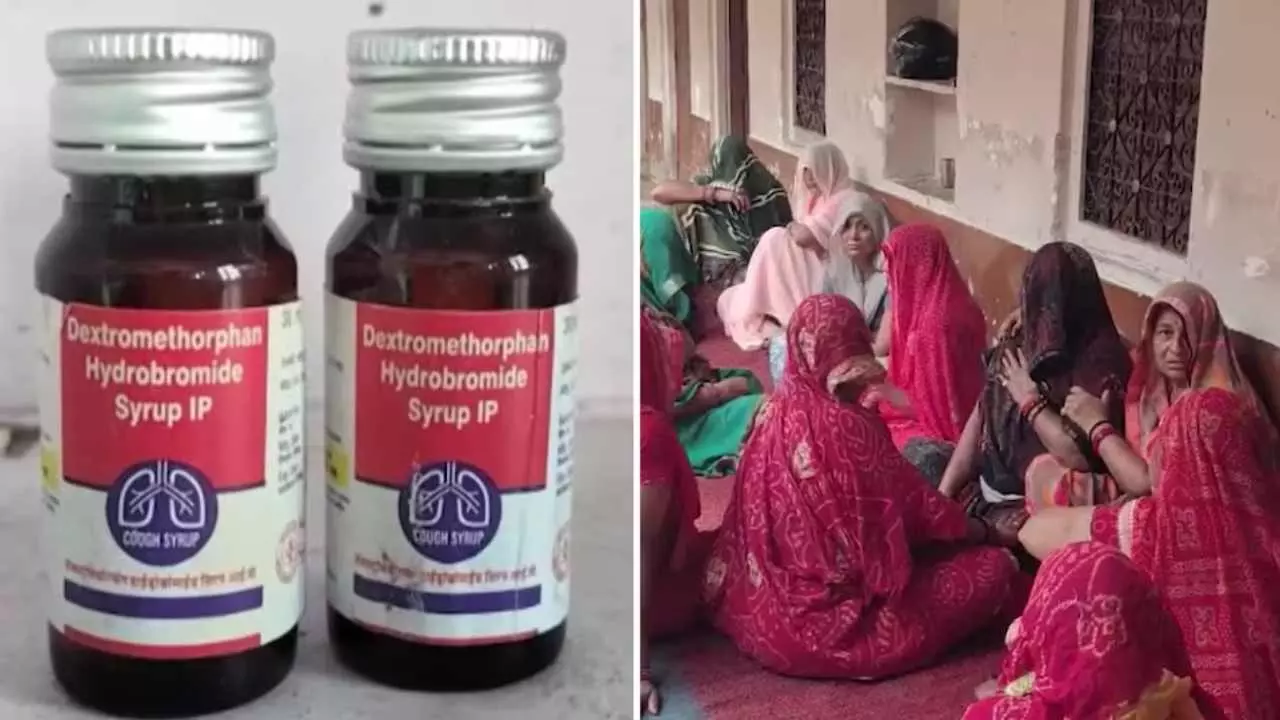
प्रारंभिक रसायन परीक्षणों से यह संकेत मिला कि ‘Coldrif’ नामक खाँसी सिरप की एक प्राप्त नमूना में DEG की मात्रा अधिक पाई गई है।
घटना की जाँच के लिए विशेषज्ञ टीमों को भेजा गया है, जिनमें NCDC, NIV, CDSCO, ICMR शामिल हैं, तथा संबंधित राज्य स्वास्थ्य विभागों के साथ समन्वय में कार्य किया जा रहा है।
केंद्रीय बैठक: निर्देश और निर्णय
केंद्र सरकार की ओर से आयोजित बैठक में निम्न मुख्य बिंदु सामने आए:
निगरानी व रिपोर्टिंग का दायरा बढ़ाना
राज्यों/संघ शासित प्रदेशों को कहा गया कि वे IDSP / IHIP प्लेटफार्म का उपयोग करते हुए समयबद्ध और सटीक रिपोर्टिंग सुनिश्चित करें।
“असामान्य स्वास्थ्य घटनाओं (unusual health events)” और “outbreak response” की स्थिति में साझा कार्रवाई हो, इसके निर्देश भी दिए गए।
Revised Schedule M / GMP अनुपालन
सभी दवा निर्माण इकाइयों को Revised Schedule M (GMP) का पालन अनिवार्य करने का निर्देश। जो इकाइयाँ अभी तक मानकों तक नहीं पहुँची हैं, उन पर विशेष निरीक्षण एवं कार्रवाई होगी।
साथ ही यह निर्णय लिया गया कि जिन इकाइयों ने उन्नयन योजनाएँ जमा की हैं, उन्हें दिसंबर 2025 तक समय दिया जाएगा।
Risk-Based Inspections (RBI)
19 दवा निर्माण इकाइयों में RBI शुरुआत की जानी है, ताकि दोषपूर्ण निर्माण इकाइयों की पहचान हो सके।
दवा वापसी और बिक्री निलंबन
संदिग्ध बैचों की दवाओं को तुरंत बाजार से वापस लेने, बिक्री पर रोक लगाने और वितरण चैनलों की जाँच की बात कही गई।
तर्कसंगत दवा उपयोग (Rational Use)
विशेष रूप से बच्चों में खाँसी / सर्दी – ज़ुकाम के लिए दवा उपयोग को परिमित रखने का निर्देश, क्योंकि अधिकतर खाँसी स्व-उपचारमूलक होती हैं और दवाओं के अवांछित दुष्प्रभाव हो सकते हैं।
अंतर-राज्य समन्वय और साझा कार्रवाई
राज्य सीमाओं में दवाओं के हस्तांतरण की निगरानी, अनुवर्ती कार्रवाई और साझा रिपोर्टिंग सुनिश्चित करने हेतु समन्वय को मजबूती देने पर जोर।
न्यायिक एवं आपराधिक कार्रवाई
यदि कोई निर्माण इकाई दोषी पाई जाती है, तो उसकी लाइसेंस रद्द करने, आपराधिक कार्यवाही शुरू करने का निर्देश।
राज्य स्तर पर प्रतिक्रियाएँ और कार्रवाइयाँ
केंद्र के निर्देशों के बाद कई राज्य सरकारों ने तुरंत कदम उठाए:
महाराष्ट्र ने Coldrif सिरप (Batch No. SR-13) की बिक्री पर पूरी तरह प्रतिबंध लगाया है।
केरल ने घोषणा की कि खाँसी सिरप बिना डॉक्टर की प्रिस्क्रिप्शन के नहीं बेचे जाएंगे।
तेलंगाना के दवा नियंत्रण प्राधिकरण ने Coldrif सिरप पर सतर्कता जारी की है और निवंधन निकालने की कार्रवाई शुरू की है।
राजस्थान में एक 5-सदस्य तकनीकी समिति गठित की गई है और दोषमुक्ति हेतु जाँच प्रारंभ की गई है।
राजस्थान स्वास्थ्य विभाग ने यह भी सुझाव दिया है कि राज्य की निःशुल्क दवा योजना में उपयोग की जाने वाली दवाओं को विशेष लेबलिंग की जाए, ताकि बच्चों एवं गर्भवती महिलाओं को संभावित खतरों की चेतावनी मिले।
ये प्रतिक्रियाएँ दर्शाती हैं कि घटना की गम्भीरता को राज्य स्तर पर भी तेजी से लिया जा रहा है, लेकिन चुनौतियाँ अभी भी बहुत बड़ी हैं।
जाँच: वैज्ञानिक विश्लेषण और प्रमाण
केंद्र ने बताया कि 19 दवा नमूनों को छिंदवाड़ा और आस-पास के इलाकों तथा हाथ में मिली दवाओं में से जमा किया गया। उनमें से लगभग 10 नमूनों का प्रारंभिक परीक्षण हुआ।
परीक्षण में 9 नमूने गुणवत्ता मानकों के अनुकूल पाए गए, लेकिन एक नमूने — Coldrif सिरप — में DEG का स्तर अधिक पाया गया।
विशेषज्ञों ने कहा है कि डाइएथिलीन ग्लाइकोल (DEG) एक विषैला रसायन है, जो गुर्दे (kidney) को प्रभावित कर सकता है, इसके सेवन से तीव्र व विषाक्त प्रभाव हो सकते हैं।
एक महत्वपूर्ण बिंदु: प्रारंभिक जांच ने सामान्य संक्रामक रोगों को लगभग नकार दिया, यानी यह संभावना कम है कि ये मौतें किसी वायरल या बैक्टीरियल संक्रमण की वजह से हुई हों।
केंद्रीय टीमों ने पर्यावरणीय, क्लिनिकल, दवा और entomological (कीटजनित) नमूने एकत्र किए हैं ताकि व्यापक विविधता में कारणों का परीक्षण किया जा सके।
इन वैज्ञानिक और जाँच संबंधी कदमों का उद्देश्य है शव परीक्षण, विषाक्त पदार्थों का विश्लेषण, वितरण चैनल की पहचान और दोषपूर्ण निर्माण इकाइयों की खोज करना।
चुनौतियाँ और आरोप
इस पूरे मामले में कई जटिलताएँ हैं, जो इसे और खतरनाक बनाती हैं:
दोषी निर्माण और नियंत्रण में चूक
यदि एक निर्माण इकाई ने intentionally या negligently अशुद्ध सामग्री (जैसे DEG) का उपयोग किया हो, तो यह गंभीर अपराध है। दवाओं की गुणवत्ता सुनिश्चित करना एक जटिल प्रक्रिया है, और हर चरण—कच्चे माल, निर्माण, पैकेजिंग, भंडारण—में नियंत्रण आवश्यक है।
लागत दबाव और शॉर्टकट
कभी-कभी दवा निर्माता कम लागत पर उत्पादन करने की लालसा में शॉर्टकट लेते हैं, जैसे सस्ते अघुलनशील सामग्री का उपयोग, गुणवत्ता परीक्षण की कार्रवाई में कमी आदि।
नियामक प्रवर्तन की कमी
यदि दवा नियंत्रक विभागों में निरीक्षण और कार्रवाई की प्रक्रिया कमजोर हो, तो दोषी इकाइयाँ बच सकती हैं।
समय पर रिपोर्टिंग की अक्षमता
यदि स्वास्थ्य केंद्र, अस्पताल और फार्मेसियों से समय पर जानकारी नहीं पहुंचे, तो समस्या को बड़ी मात्रा में फैलने का मौका मिलता है।
उपभोक्ताओं की जागरूकता का अभाव
आम जनता में यह जानकारी कम होती है कि दवा खरीदी करते समय बैच नंबर, एक्सपायरी, निर्माता का नाम, असमर्थित स्रोत — ये सब जाँचना महत्वपूर्ण है।
अन्य संभावित कारणों की छानबीन
यह जरूरी है कि मौतों का कारण सिर्फ दवा ही हो — अन्य कारणों (वायरस, संक्रमण, पर्यावरणीय विषैले तत्व) की पूरी तरह जाँच की जाए।
वित्तीय दावे और मुआवजा
मृतकों के परिजनों को न्याय और मुआवजा सुनिश्चित करना, और दोषी कंपनियों को कानूनी दायित्वों से न छोड़ा जाना।
सामाजिक विश्वास का ध्वस्त होना
ऐसी घटनाएँ इस विश्वास को हिला देती हैं कि “दवाएँ सुरक्षित होंगी” — जो कि स्वास्थ्य प्रणाली के लिए घोर संकट है।
अन्य देशों में पूर्व अनुभव: अलार्म और चेतावनियाँ
यह पहला मामला नहीं है। पहले भी विश्व स्तर पर मिलावटी खाँसी सिरप से बच्चों की मौत हुई है:
2022 में गाम्बिया में भारतीय निर्मित खाँसी सिरप से लगभग 70 बच्चों की मृत्यु हुई — WHO ने उस घटना को एक Medical Product Alert जारी किया था।
उज़्बेकिस्तान में भी 2022 में खाँसी सिरप से 18 बच्चों की मौत हुई थी, जिसमें दोषी निर्माता Marion Biotech को निलंबित किया गया।
इन घटनाओं ने पहले ही भारत और अन्य देशों को चेताया था कि दवा निर्माण और निर्यात मानकों को कड़ाई से लागू करना ज़रूरी है। आज की घटना उसी चेतावनी को दुहराती है।
क्या अब किया जाना चाहिए? — केंद्र और राज्य के लिए प्राथमिक सिफारिशें
यहाँ वे कदम दिए जाते हैं जो तुरंत और दीर्घकालिक रूप से उठाए जाने चाहिए:
तत्काल दवा वापसी
सभी संभावित संदिग्ध बैचों की खाँसी सिरप को तुरंत बाजार से वापस लें और वितरण चैनलों को अविलंब ताला लगाएँ।
स्वतंत्र परीक्षण सुविधाएँ
केंद्रीय और राज्य स्तर पर अधिक लैब परीक्षण सुविधाएँ स्थापित करें, ताकि नमूने तेजी से जाँचे जा सकें।
दवा निर्माण इकाइयों का सख्त ऑडिट
सभी फार्मा कंपनियों पर नियमित ऑडिट और निरीक्षण जारी रखें। किसी भी अनियमितता पर लाइसेंस रद्द और आपराधिक कार्रवाई सुनिश्चित करें।
मानकीकृत प्रशिक्षण
दवा निर्माण कर्मियों, गुणवत्ता विभागों और फार्मासिस्टों को GMP, HACCP, QC (Quality Control) आदि विषयों पर नियमित प्रशिक्षण दें।
निगरानी नेटवर्क विस्तार
छोटे और दूरदराज के क्षेत्रों में स्वास्थ्य निगरानी केंद्रों और रिपोर्टिंग नेटवर्क को मजबूत करें, ताकि पहले लक्षणों को पकड़ा जा सके।
सार्वजनिक जागरूकता अभियान
आम जनता को यह जानकारी दें कि दवा खरीदते समय क्या देखें — बैच नंबर, निर्माता, एक्सपायरी, QR कोड, सरकार द्वारा मान्यता आदि।
दवा उपयोग प्रोटोकॉल
डॉक्टरों को दिशानिर्देश दें कि खाँसी/सर्दी जैसी सामान्य बीमारियों में बिना आवश्यकता के खाँसी सिरप न दें, विशेषकर बच्चों को।
मुआवजा और न्याय प्रक्रिया तेज करना
मृतकों के परिजनों को शीघ्र न्याय मिले — प्रभावितों को मुआवजा दिलाने की प्रक्रिया को समयबद्ध करें।
अंतर-राष्ट्रीय समन्वय
यदि कोई दवा निर्यात हुई हो, तो संबंधित देशों के स्वास्थ्य विभागों से मिलकर जाँच करें।
नवीनतम प्रौद्योगिकी उपयोग
QR कोड, मोबाइल ऐप्स, ब्लॉकचेन आदि तकनीकों का उपयोग करें जिससे दवा वास्तविकता की जाँच हो सके।
लोगों के किस्से, दर्द और विरोधाभास
जब इस त्रासदी के समाचार फैलने लगे, तो अनेक परिवारों की त्रासदी सुनने को मिली:
एक माता का रोना, “मैंने वही बताया था कि सिरप से पहले देखकर दूँगी, पर बच्चे बहुत बीमार थे, इंतजार नहीं हो सका” — ऐसी कहानियाँ दिल को झकझोर देती हैं।
एक डॉक्टर ने कहा, “हम दवाओं पर भरोसा करते हैं। यदि दवा सुरक्षित न हो, तो हम किस पर भरोसा करें?”
विरोधी दल सरकारों पर आरोप लगा रहे हैं कि स्वास्थ्य विभागों की लापरवाही और निरीक्षण की कमी इस घटना की वजह बनी।
इन मानवीय दृष्टिकोणों ने इस विषय को केवल तकनीकी या नीति समस्या नहीं, बल्कि सामाजिक-नैतिक प्रश्न बना दिया है।
Note: Content and images are for informational use only. For any concerns, contact us at info@rajasthaninews.com.
40 के बाद शर्ट से बा...
Related Post
Hot Categories
Recent News
Daily Newsletter
Get all the top stories from Blogs to keep track.





_1772465804.jpg)
_1772465408.jpg)
_1772464394.jpg)
_1772463878.jpg)
